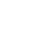病毒清除验证
 服务简述
服务简述
病毒清除验证研究服务可为药品提供整体安全性证明,是从药品工艺研发到新药临床申报(IND)再到生物制品许可申请(BLA)的重要步骤。
病毒清除或灭活工艺的评价和鉴定对生物技术产品的安全性起着重要的作用。过去发生的多例污染事件是由于使用未知甚至未被怀疑的受污染的原材料导致的。虽然这种情况在经充分表征的细胞系制备的产品中并没有发生,而是发生在从其它原材料中制备的生物制品中,但是病毒清除评价可使我们确信那些未知的、预想不到和有害的病毒都有可能被清除。病毒清除研究必须被详细记录并在受控条件下进行。
病毒清除验证研究服务可为药品提供整体安全性证明,是从药品工艺研发到新药临床申报(IND)再到生物制品许可申请(BLA)的重要步骤。
微谱实验室缩小模型可去除/灭活外来因子以验证下游纯化过程,并提供有效的病毒清除平台设计服务,帮您解决后顾之忧!
 研究关键
研究关键
01、方案设计的合理性;
02、资源配置的充分性;
03、研究方法的多元性;
04、质量体系的合规性;
05、研究全程的可控性;
06、基于风险的后续设计。
 服务内容
服务内容
01、抗体类;
02、重组蛋白;
03、基因治疗载体;
04、AV疫苗;
05、医疗器械;
06、其他动物体液/组织来源制品。
 覆盖的工艺流程
覆盖的工艺流程
01、Low PH 法;
02、纳米过滤;
03、层析:阳离子层析、亲和层析、阴离子层析、其他层析;
04、溶剂洗涤法(SD法)
 服务优势
服务优势
01、参考中美欧等监管法规进行科学试验设计;
▼ 下表来源:ICH R2 2022版
.png)
02、百余人专家团队、近400精密仪器、50种菌毒种;
▼ 下表来源:ICH R2 2022版
03、符合申报溯源的病毒资源;
04、可实现VC研究目标的纯化工艺;
05、病毒滴度足够支持实现方案预期;
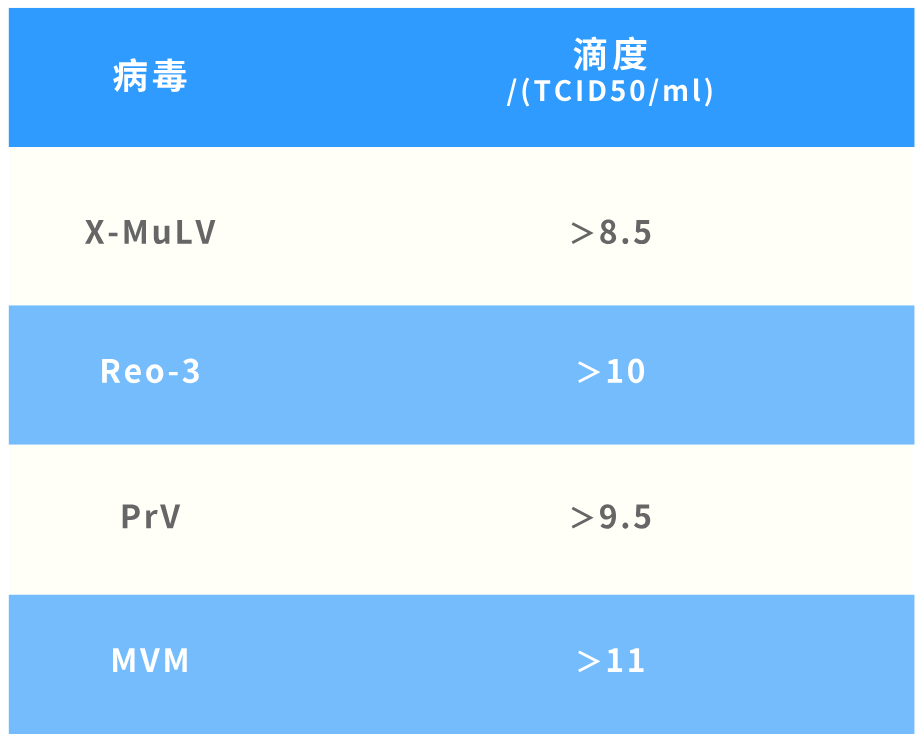
06、支持实现TCID50\Plaque assay \q-PCR等方法;

07、实验室参照 ISO 17025/GMP 双质量体系运行;
08、研究数据可支持实现中美欧等申报;
09、覆盖工艺成熟齐全、过程可控,周期短交付快;
10、充分表征、详细记录,实施中定期项目汇报。
 常见问题及解答
常见问题及解答
-
01.开启试验前,企业担心自己的工艺过程不能有效地实现病毒清除验证?答:
一方面目前生物药常见的工艺过程已经有了一部分数据积累,还有一些已经有对应的研究文章报道,可以针对已经申报的参数进行对比;另外,在开启申报前也可以进行预实验来估算。当然最终还是以正式VC试验的落实来评估。
-
02.病毒应该如何选择,有什么要求吗?答:
这些病毒可分为三类:“相关”病毒、特异“模型”病毒和非特异“模型”病毒。应选择具有不同特性的非特异性 “模型” 病毒,包括 DNA/RNA、有/无包膜、颗粒大小、尤其对物理/化学处理明显耐受的病毒等。法规给了一些指导但是生产商也可考虑使用其他病毒,特别是对他们自身生产工艺更适合的病毒。一般说来,至少要用三种不同特性的病毒对工艺的清除病毒能力进行评价。
-
03.是否需要甲方到现场进行试验?可不可以不去答:
最终目的是达到工艺一致性,如果生产商可以共享参数信息,并且把对应的耗材充分准备,不管是生厂商现场还是微谱自己操作工艺都可以顺利完成。